¿PUEDEN GENERAR RESISTENCIA A LOS DESINFECTANTES?
La respuesta a esta pregunta involucra directamente decisiones en los procedimientos de limpieza y desinfección (L+D) en plantas procesadoras de alimentos. Para entender como las bacterias podrían generar resistencia a los desinfectantes, se debe conocer el modo de acción por el cual estos eliminan bacterias, y además, cuáles son los mecanismos de resistencia que las bacterias poseen. Los mecanismos de resistencia más estudiados de las bacterias son a los antibióticos. Estos últimos, pueden matar a las bacterias (bactericidas) o impedir que crezcan (bacteriostático). La adquisición de los mecanismos de resistencia a antibiótico puede ser por transferencia horizontal de plásmidos u otros elementos genéticos de bacterias que se co-localizan con el patógeno. Además, alternativamente, la resistencia puede ocurrir a través de transmisión vertical por mutaciones cromosómicas (Chambless et al., 2006).
LOS 4 PRINCIPALES MECANISMOS DE RESISTENCIA FRENTE A ANTIBIÓTICOS (FIG. 1) QUE PRESENTAN LAS BACTERIAS SON:
1) Enzimas hidrolíticas: Las bacterias sintetizan enzimas que hidrolizan al antibiótico, destruyendo su acción antibacteriana, sin tener posibilidad de actuar sobre el microorganismo (Davies, 1994; Kumar & Varela, 2013).
2) Modificación del sitio activo: La modificación de un aminoácido genera un blanco diferente y así disminuye la afinidad de unión por el antibiótico (Ramirez & Tolmasky, 2010).
3) Disminución de la permeabilidad de la pared celular al ingreso del antibiótico: Cambios en el diámetro y/o número de porinas pueden bloquear el ingreso del antibiótico a la bacteria (Džidić et al., 2008; Nikaido, 2003). Además, existe disminución de la expresión de porinas lo que disminuye la susceptibilidad a betalactámicos y fluoroquinolonas en Pseudomonas (Hancock & Brinkman, 2002).
4) Bombas de eflujo: Transporta el antibiótico hacia el exterior de la célula sin modificaciones, pero sin acción antimicrobiana. Existen bombas de eflujos multidrogas en la pared bacteriana que permiten la expulsión de drogas como los antibióticos (Nikaido & Zgurskaya, 1999; Webber & Piddock, 2003). Los genes involucrados son mefA (Streptococcus pneumoniae), norA (Staphylococcus aureus) y mex (Pseudomonas aeruginosa) (Džidić et al., 2008).
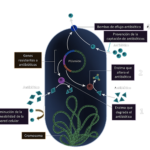
Figura 1. Mecanismos de resistencia a antibiótico. Los principales mecanismos de resistencia a antibiótico son:
1- Enzimas que hidrolizan al antibiótico
2- Disminución de la afinidad por el antibiótico
3- Disminución de la permeabilidad de la pared celular al ingreso del antibiótico
4-Bombas de eflujo (Jansen et al., 2018).
Todos estos mecanismos son específicos y desde un punto de vista energético, no involucra mayores cambios en las bacterias para lograr inactivar a los antibióticos. De esta manera, estos mismos compuestos actúan de manera específica interaccionando con los componentes de membrana, enzimas intracelulares y/o ácidos nucleicos.
Por otra parte, la mayoría de los estudios en desinfectantes están enfocados en los mecanismos de acción. Uno de los principales desinfectantes usados en industria alimentaria es el ácido peracético. El mecanismo de acción se centra en ser un agente oxidante (Liberti et al., 2000), es decir: desnaturaliza las proteínas, interrumpe la función quimiosmótica de lipoproteínas de membrana citoplasmática y transporte por dislocación o ruptura de paredes celulares (Baldry, 1988; Leaper, 1984; Maris, 1995). Por lo tanto, puede ser que sea igualmente efectivo en el exterior, en lipoproteínas de membrana, facilitando su acción contra las bacterias Gram negativas (Leaper, 1984). Por otro lado, puede romper la permeabilidad de la pared celular y oxidar enlaces sulfhidrilo y azufre en proteínas, enzimas y otros metabolitos. Además, una ventaja importante del ácido peracético es que puede inactivar la catalasa, una enzima conocida por desintoxicar los radicales hidroxilos libres (Block, 2001).
Otro desinfectante de gran uso en la industria alimentaria son las Sales de Amonio Cuaternario (SAC). Estas, son agentes activos que interactúan con lípidos o proteínas de la membrana citoplásmica de bacterias y levaduras (Maris, 1995). Su actividad hidrofóbica hace que también sean efectivos contra los virus que contienen lípidos. Los SAC también pueden interactuar con dianas intracelulares y se unen al ADN (Zinchenko et al., 2004). De hecho, se ha propuesto que su mecanismo de acción contra microorganismos sería: adsorción de SAC y penetración de la pared celular; (II) reacción con la membrana citoplasmática (lípido o proteína), seguida de desorganización de la membrana; (III) salida del material intracelular de menor peso; degradación de proteínas y ácidos nucleicos; y lisis de la pared celular causada por enzimas autolíticas (McDonnell, 2007).
Por lo cual, desde el punto de vista energético, es muy costoso para las bacterias lograr generar una resistencia a compuestos citotóxicos como lo son los desinfectantes, ya que sus mecanismos de acción no son específicos (a diferencia de los antibióticos).
Sin embargo, se ha reportado en literatura resistencia a SAC por Listeria monocytogenes usando bombas de eflujo. Lo cual, contradice lo expuesto recientemente. Al analizar en detalle estos estudios, podemos encontrar que la máxima concentración de resistencia varía desde 1 – 40 ppm (Aase et al., 2000; Kovacevic et al., 2016; Martínez-Suárez et al., 2016; Pang et al., 2019). Sin embargo, en la mayoría de estos estudios se habla realmente de ”tolerancia” y se determina en concentraciones subletales. Debido a que la aplicación de SAC en la industria de alimentos es en concentraciones entre 150 – 1000 ppm (Ferreira et al., 2014; Tezel and Pavlostathis, 2015).
En base a lo señalado anteriormente, ¿Qué nos hace aseverar que a concentraciones entre 150 – 1000 ppm crecerá L. monocytogenes que pueda adquirir resistencia?
Considerando que los SACs presentan concentraciones mínimas inhibitorias (MICs) del crecimiento de L. monocytogenes entre 0,5 – 36 ppm, y además, la máxima concentración de resistencia reportada es de 40 ppm. Se infiere que L. monocytogenes no presentaría resistencia a este desinfectante en plantas procesadoras de alimentos, si se respetan las concentraciones de uso recomendadas por el fabricante. Entonces, si todo es tan favorable para la industria procesadora de alimentos, ¿por qué nos vemos enfrentado a problemas de contaminación microbiológica en las plantas?
La respuesta a esto nos lleva a la formación de biofilms, estos se definen como una comunidad de microorganismos embebidos en una matriz extracelular, compuesta principalmente por un exopolisacaridos (EPS) y proteínas. Los biofilms son producidos por las propias bacterias, y les confieren propiedades de tolerancia a agentes antimicrobianos (Decho, 1990; Meyer-Reil, 1994).
Una vez que el biofilm alcanza un estado de madurez, los compuestos desinfectantes (en especial los oxidantes) se consumen interaccionando con la matriz del biofilm (aproximadamente entre un 70 a 90 % del contenido del biofilm es la matriz) y con las células bacterianas en la periferia (Chambless et al., 2006), generando una lenta penetración e impidiendo la difusión de los desinfectantes hacia el seno del biofilm, permitiendo sobrevivir a las células en el interior
(Fig. 2).

Figura 2. Posibles mecanismos de tolerancia a antimicrobianos de biofilms. La imagen es una sección transversal de un Biofilm, en la parte inferior y la fase acuosa que contiene el antimicrobiano (amarillo) en la parte superior. Algunas bacterias pueden activar las respuestas a estrés (verde), mientras que otras pueden diferenciarse en un fenotipo protegido (púrpura) (Chambless et al., 2006).
Por lo tanto, la formación de biofilms en superficies de contacto directo e indirecto con el alimento, es el real problema al que se ven enfrentadas las plantas procesadoras de alimentos en sus procedimientos de L+D e inocuidad. Si bien, existen estudios que evalúan el comportamiento de biofilm en presencia de desinfectantes, se hacen necesarios estudios centrados en la formación de Biofilm en plantas procesadoras de alimentos que permitan establecer bases para el control adecuado de las bacterias patógenas.
AUTORES:
José Miguel Vidal Araya, Ingeniero en Biotecnología, MsC Microbiología, Investigador Universidad de Concepción, Gerente Técnico ECOMBIO LIMITADA. Pamela Andrea Ruiz Merino, Ingeniero en Biotecnología, PhD Biociencias Moleculares, Investigador Universidad de Concepción, Asesor ECOMBIO LIMITADA.
REFERENCIAS:
- Aase, B., Sundheim, G., Langsrud, S., Rørvik, L.M. 2000. Occurrence of and a possible mechanism for resistance to a quaternary ammonium compound in Listeria monocytogenes. International journal of food microbiology 62, 57-63
- Baldry, M. 1988. Disinfection with peroxygens. Industrial biocides; Critical reports on applied chemistry 23, 91-116
- Block, S.S. (2001). Disinfection, sterilization, and preservation: Lippincott Williams & Wilkins.
- Chambless, J.D., Hunt, S.M., Stewart, P.S. 2006. A three-dimensional computer model of four hypothetical mechanisms protecting biofilms from antimicrobials. Appl. Environ. Microbiol. 72, 2005-2013
- Davies, J. 1994. Inactivation of antibiotics and the dissemination of resistance genes. Science 264, 375-382
- Decho, A.W. 1990. Microbial exopolymer secretions in ocean environments: their role (s) in food webs and marine processes. Oceanogr Mar Biol 28, 9-16
- Džidić, S., Šušković, J., Kos, B. 2008. Antibiotic resistance mechanisms in bacteria: biochemical and genetic aspects. Food Technology & Biotechnology 46
- Ferreira, V., Wiedmann, M., Teixeira, P., Stasiewicz, M. 2014. Listeria monocytogenes persistence in food-associated environments: epidemiology, strain characteristics, and implications for public health. Journal of food protection 77, 150-170
- Hancock, R.E., Brinkman, F.S. 2002. Function of Pseudomonas porins in uptake and efflux. Annual Reviews in Microbiology 56, 17-38
- Jansen, K.U., Knirsch, C., Anderson, A.S. 2018. The role of vaccines in preventing bacterial antimicrobial resistance. Nature medicine 24, 10
- Kovacevic, J., Ziegler, J., Wałecka-Zacharska, E., Reimer, A., Kitts, D.D., Gilmour, M.W. 2016. Tolerance of Listeria monocytogenes to quaternary ammonium sanitizers is mediated by a novel efflux pump encoded by emrE. Appl. Environ. Microbiol. 82, 939-953
- Kumar, S., Varela, M.F. 2013. Molecular mechanisms of bacterial resistance to antimicrobial agents. chemotherapy 14, 18
- Leaper, S. 1984. Synergistic killing of spores of Bacillus subtilis by peracetic acid and alcohol. International Journal of Food Science & Technology 19, 355-360
- Liberti, L., Lopez, A., Notarnicola, M., Barnea, N., Pedahzur, R., Fattal, B. 2000. Comparison of advanced disinfecting methods for municipal wastewater reuse in agriculture. Water Science and Technology 42, 215-220
- Maris, P. 1995. Modes of action of disinfectants. Revue Scientifique et Technique-Office International des Epizooties 14, 47-47
- Martínez-Suárez, J.V., Ortiz, S., López-Alonso, V. 2016. Potential impact of the resistance to quaternary ammonium disinfectants on the persistence of Listeria monocytogenes in food processing environments. Frontiers in microbiology 7, 638
- McDonnell, G.E. (2007). Antisepsis, disinfection, and sterilization: types, action and resistance: ASM press.
- Meyer-Reil, L.-A. 1994. Microbial life in sedimentary biofilms-the challenge to microbial ecologists. Marine ecology progress series. Oldendorf 112, 303-311
- Nikaido, H. 2003. Molecular basis of bacterial outer membrane permeability revisited. Microbiol. Mol. Biol. Rev. 67, 593-656
- Nikaido, H., Zgurskaya, H.I. 1999. Antibiotic efflux mechanisms. Current opinion in infectious diseases 12, 529-536
- Pang, X., Wong, C., Chung, H.-J., Yuk, H.-G. 2019. Biofilm formation of Listeria monocytogenes and its resistance to quaternary ammonium compounds in a simulated salmon processing environment. Food Control 98, 200-208
- Ramirez, M.S., Tolmasky, M.E. 2010. Aminoglycoside modifying enzymes. Drug Resistance Updates 13, 151-171
- Tezel, U., Pavlostathis, S.G. 2015. Quaternary ammonium disinfectants: microbial adaptation, degradation and ecology. Current opinion in biotechnology 33, 296-304
- Webber, M., Piddock, L. 2003. The importance of efflux pumps in bacterial antibiotic resistance. Journal of Antimicrobial Chemotherapy 51, 9-11
- Zinchenko, A.A., Sergeyev, V.G., Yamabe, K., Murata, S., Yoshikawa, K. 2004. DNA compaction by divalent cations: structural specificity revealed by the potentiality of designed quaternary diammonium salts. ChemBioChem 5, 360-368
- Chambless, J.D., Hunt, S.M., Stewart, P.S. 2006. A three-dimensional computer model of four hypothetical mechanisms protecting biofilms from antimicrobials. Appl. Environ. Microbiol. 72, 2005-2013

